Exemplo De Reação Quimica De Dupla Troca – Exemplo De Reação Química De Dupla Troca, um tipo fundamental de reação química, ocorre quando dois reagentes iônicos trocam seus íons, formando novos produtos. Essa troca de íons resulta em uma reorganização dos átomos e moléculas, criando substâncias completamente novas.
O estudo das reações de dupla troca é essencial para compreender os princípios básicos da química, e sua aplicação abrange áreas diversas, como a síntese de novos materiais, o tratamento de água e a produção de medicamentos.
Neste artigo, vamos mergulhar no mundo das reações de dupla troca, explorando seus mecanismos, tipos, aplicações e os fatores que influenciam sua ocorrência. Abordaremos exemplos práticos e relevantes, incluindo reações de dupla troca em química orgânica, para proporcionar uma compreensão abrangente do tema.
Introdução à Reação de Dupla Troca
Uma reação de dupla troca, também conhecida como reação de metátese, é um tipo de reação química onde dois reagentes iônicos trocam seus íons para formar dois novos produtos. Essas reações são comuns na química inorgânica e ocorrem em soluções aquosas.
Exemplo de Reação de Dupla Troca
Um exemplo simples de uma reação de dupla troca é a reação entre cloreto de sódio (NaCl) e nitrato de prata (AgNO3):
NaCl(aq) + AgNO3(aq) → NaNO3(aq) + AgCl(s)
Nessa reação, o sódio (Na+) do cloreto de sódio combina-se com o nitrato (NO3-) do nitrato de prata para formar nitrato de sódio (NaNO3), enquanto o prata (Ag+) do nitrato de prata combina-se com o cloro (Cl-) do cloreto de sódio para formar cloreto de prata (AgCl).
Condições para que uma Reação de Dupla Troca Ocorra, Exemplo De Reação Quimica De Dupla Troca
Para que uma reação de dupla troca ocorra, algumas condições devem ser satisfeitas:
- Os reagentes devem ser compostos iônicos.
- Pelo menos um dos produtos deve ser insolúvel em água, ou seja, deve formar um precipitado.
- Pelo menos um dos produtos deve ser um gás.
- Pelo menos um dos produtos deve ser uma molécula de água.
Se nenhuma dessas condições for satisfeita, a reação não ocorrerá ou ocorrerá em uma extensão muito pequena.
Mecanismo da Reação de Dupla Troca
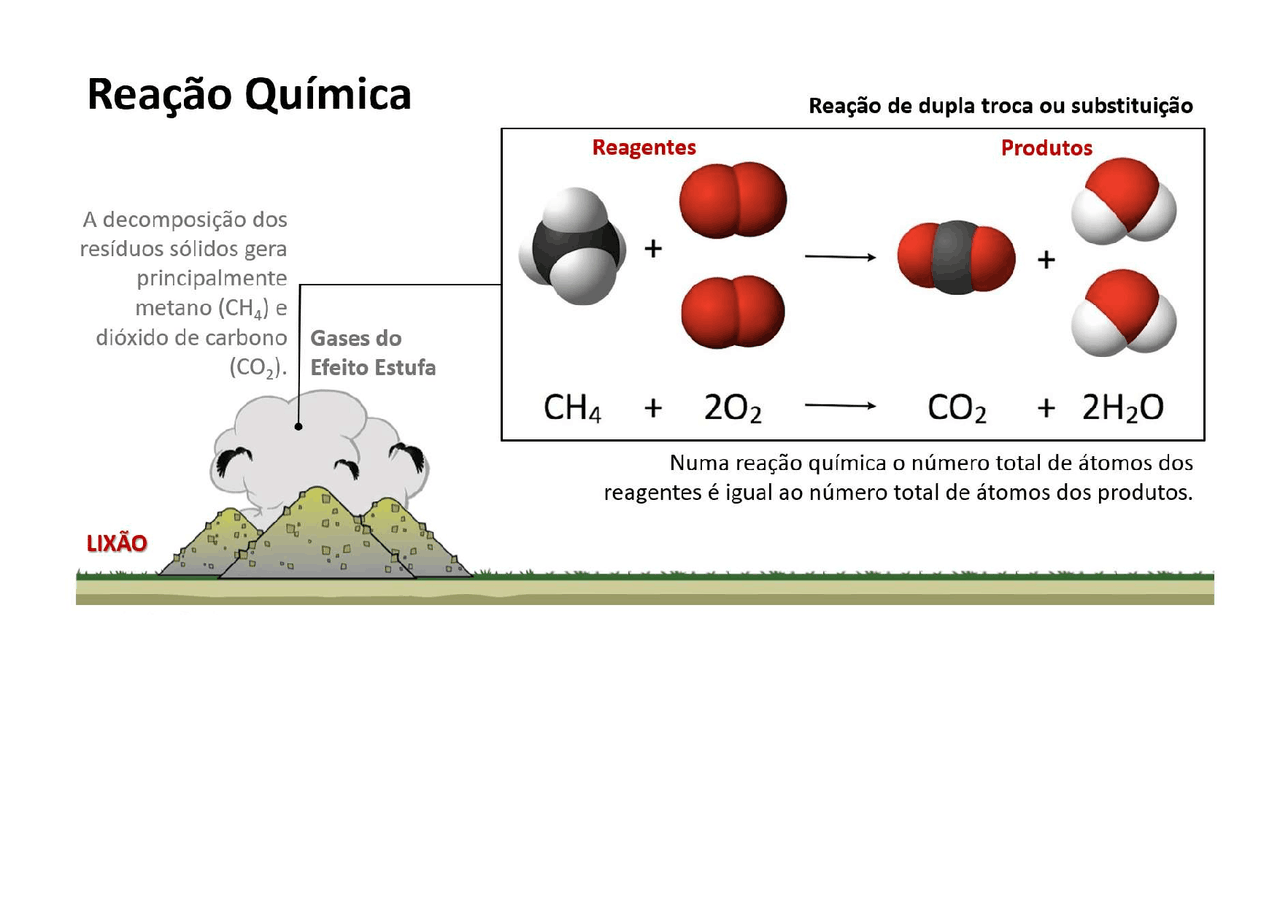
As reações de dupla troca, também conhecidas como reações de metátese, envolvem a troca de íons entre dois reagentes, resultando na formação de dois novos produtos. Para entender como essa troca acontece, é essencial compreender o mecanismo da reação.
Etapas da Reação de Dupla Troca
O mecanismo da reação de dupla troca pode ser dividido em etapas distintas:
- Formação de íons:Os reagentes iônicos, geralmente sais, se dissolvem em solução, liberando cátions e ânions. Por exemplo, o cloreto de sódio (NaCl) se dissocia em íons sódio (Na+) e íons cloreto (Cl-).
- Colisão e Interação:Os íons liberados dos reagentes se chocam aleatoriamente na solução. Se a colisão for bem-sucedida, os íons com cargas opostas se atraem, formando novos pares iônicos.
- Formação de Produtos:A formação de novos pares iônicos leva à formação de novos compostos. Se esses compostos forem insolúveis, eles precipitarão da solução, enquanto os compostos solúveis permanecerão dissolvidos.
Diagrama de Fluxo da Reação de Dupla Troca
Para ilustrar melhor o mecanismo da reação de dupla troca, podemos utilizar um diagrama de fluxo:“`Reagentes (AB + CD)
- > Dissolução em solução
- > Íons (A+ + B- + C+ + D-)
- > Colisão e Interação
- > Novos Pares Iônicos (AC + BD)
- > Formação de Produtos (precipitado ou dissolvido)
“`
Comparação com Outros Tipos de Reações
O mecanismo da reação de dupla troca difere de outros tipos de reações químicas, como as reações de adição, eliminação e substituição. Em reações de adição, duas ou mais moléculas se combinam para formar uma molécula maior. Em reações de eliminação, uma molécula perde átomos ou grupos de átomos para formar uma molécula menor.
Já em reações de substituição, um átomo ou grupo de átomos em uma molécula é substituído por outro átomo ou grupo de átomos.As reações de dupla troca, por sua vez, envolvem a troca de íons entre reagentes, sem a formação ou quebra de ligações covalentes.
Essa característica as distingue de outros tipos de reações, como as reações de adição, eliminação e substituição.
Tipos de Reações de Dupla Troca
As reações de dupla troca, como já vimos, envolvem a troca de íons entre dois reagentes, resultando na formação de dois novos produtos. Essas reações podem ser classificadas em diferentes tipos, dependendo da natureza dos produtos formados e das condições de reação.As reações de dupla troca podem ser classificadas em quatro tipos principais:
Reações de Neutralização
As reações de neutralização são um tipo específico de reação de dupla troca que ocorre entre um ácido e uma base. Nessa reação, os íons hidrogênio (H+) do ácido reagem com os íons hidróxido (OH-) da base, formando água (H2O) e um sal.
Exemplo: A reação entre ácido clorídrico (HCl) e hidróxido de sódio (NaOH) forma cloreto de sódio (NaCl) e água (H2O):HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
A principal característica da reação de neutralização é a formação de água como um dos produtos, além do sal. A água é um composto neutro, enquanto o sal pode ser ácido, básico ou neutro, dependendo da força do ácido e da base que reagiram.
Reações de Precipitação
As reações de precipitação ocorrem quando dois reagentes aquosos reagem, formando um produto insolúvel, chamado precipitado, que se separa da solução como um sólido. O precipitado é geralmente um composto iônico que não é solúvel no solvente usado.
Exemplo: A reação entre nitrato de prata (AgNO3) e cloreto de sódio (NaCl) forma cloreto de prata (AgCl), um sólido branco insolúvel, e nitrato de sódio (NaNO3), que permanece em solução:AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)
A característica principal das reações de precipitação é a formação de um precipitado, que pode ser identificado visualmente como um sólido que se separa da solução.
Reações de Formação de Gás
As reações de formação de gás ocorrem quando dois reagentes reagem, formando um produto gasoso que escapa da solução. O gás formado é geralmente um composto molecular que é volátil à temperatura ambiente.
Exemplo: A reação entre ácido clorídrico (HCl) e carbonato de cálcio (CaCO3) forma cloreto de cálcio (CaCl2), água (H2O) e dióxido de carbono (CO2), um gás incolor e inodoro:
HCl(aq) + CaCO3(s) → CaCl2(aq) + H2O(l) + CO2(g)
A característica principal das reações de formação de gás é a liberação de um gás, que pode ser observado como bolhas que se formam na solução.
Reações de Metátese
As reações de metátese são um tipo mais amplo de reação de dupla troca que envolve a troca de íons entre dois reagentes, sem necessariamente formar um precipitado ou um gás. Essas reações podem ocorrer entre compostos iônicos ou moleculares, e são frequentemente usadas em síntese química para preparar novos compostos.
Exemplo: A reação entre cloreto de sódio (NaCl) e nitrato de prata (AgNO3) forma cloreto de prata (AgCl), um sólido branco insolúvel, e nitrato de sódio (NaNO3), que permanece em solução:NaCl(aq) + AgNO3(aq) → AgCl(s) + NaNO3(aq)
A característica principal das reações de metátese é a troca de íons entre os reagentes, resultando na formação de novos produtos.
Aplicações da Reação de Dupla Troca
A reação de dupla troca, também conhecida como reação de metátese, é um processo químico fundamental que desempenha um papel crucial em diversas áreas, desde a produção de produtos químicos essenciais até a aplicação em diversas tecnologias. A reação de dupla troca é uma reação que ocorre quando dois reagentes iônicos reagem para formar dois novos produtos iônicos.
Os íons dos reagentes trocam de lugar para formar os novos produtos. Essa reação é amplamente utilizada em várias indústrias e tem um impacto significativo na sociedade.
Aplicações da Reação de Dupla Troca em Diferentes Áreas
A reação de dupla troca é um processo versátil que encontra aplicação em diversas áreas, incluindo:
- Síntese de compostos químicos:A reação de dupla troca é amplamente utilizada na síntese de uma variedade de compostos químicos, como sais, óxidos, hidróxidos e outros compostos inorgânicos. Por exemplo, a reação de dupla troca entre o cloreto de sódio (NaCl) e o nitrato de prata (AgNO3) produz cloreto de prata (AgCl), um composto insolúvel, e nitrato de sódio (NaNO3), um composto solúvel.
AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)
- Produção de fertilizantes:A reação de dupla troca é utilizada na produção de fertilizantes, como o sulfato de amônio ((NH4)2SO4), que é um fertilizante nitrogenado importante. A reação de dupla troca entre o amoníaco (NH3) e o ácido sulfúrico (H2SO4) produz sulfato de amônio e água.
2NH3(g) + H2SO4(aq) → (NH4)2SO4(aq)
- Tratamento de água:A reação de dupla troca é utilizada no tratamento de água para remover íons metálicos indesejáveis, como chumbo e mercúrio. A reação de dupla troca entre os íons metálicos e um reagente apropriado, como o hidróxido de sódio (NaOH), produz um precipitado insolúvel que pode ser removido da água.
Pb2+(aq) + 2OH-(aq) → Pb(OH)2(s)
- Indústria de alimentos:A reação de dupla troca é utilizada na indústria de alimentos para a produção de produtos como queijo, iogurte e outros produtos lácteos. A reação de dupla troca entre o leite e o coalho, uma enzima, produz coalho, que é usado para coagular o leite.
- Indústria farmacêutica:A reação de dupla troca é utilizada na indústria farmacêutica para a síntese de medicamentos, como antibióticos e analgésicos. A reação de dupla troca entre dois reagentes apropriados pode produzir o medicamento desejado.
Impacto da Reação de Dupla Troca na Sociedade
A reação de dupla troca tem um impacto significativo na sociedade, pois é fundamental para a produção de uma variedade de produtos essenciais, como:
- Fertilizantes:A produção de fertilizantes por meio de reações de dupla troca é crucial para aumentar a produtividade agrícola e garantir a segurança alimentar global.
- Medicamentos:A síntese de medicamentos por meio de reações de dupla troca é essencial para o tratamento de doenças e a melhoria da saúde humana.
- Produtos químicos:A produção de produtos químicos essenciais, como sais, óxidos e hidróxidos, por meio de reações de dupla troca é fundamental para uma ampla gama de indústrias, desde a produção de plásticos até a fabricação de baterias.
- Tratamento de água:O uso de reações de dupla troca no tratamento de água é essencial para garantir o acesso à água potável e segura para consumo humano.
Fatores que Influenciam a Reação de Dupla Troca
A velocidade de uma reação de dupla troca, como qualquer outra reação química, é influenciada por diversos fatores. Compreender esses fatores é crucial para controlar e otimizar o processo de reação.
Temperatura
A temperatura é um dos principais fatores que influenciam a velocidade de uma reação química. Um aumento na temperatura geralmente leva a um aumento na velocidade da reação. Isso ocorre porque a temperatura fornece mais energia cinética às moléculas reagentes, aumentando a frequência de colisões eficazes e, consequentemente, a velocidade da reação.
A regra geral é que a velocidade da reação dobra a cada 10°C de aumento na temperatura.
Concentração
A concentração dos reagentes também influencia a velocidade da reação de dupla troca. Um aumento na concentração dos reagentes leva a um aumento na frequência de colisões entre as moléculas, o que aumenta a probabilidade de colisões eficazes e, portanto, a velocidade da reação.
Em geral, a velocidade da reação é proporcional à concentração dos reagentes.
Catalisadores
Catalisadores são substâncias que aceleram a velocidade de uma reação química sem serem consumidas no processo. Eles funcionam fornecendo um caminho alternativo de menor energia para a reação, reduzindo a energia de ativação necessária para que a reação ocorra.
Por exemplo, a adição de um catalisador ácido a uma reação de dupla troca pode aumentar a velocidade da reação, tornando-a mais rápida e eficiente.
Equilíbrio Químico
As reações de dupla troca, como qualquer reação química, atingem um estado de equilíbrio químico. Nesse estado, a velocidade da reação direta é igual à velocidade da reação inversa. O equilíbrio químico é dinâmico, o que significa que as reações direta e inversa continuam a ocorrer, mas em taxas iguais.
O princípio de Le Chatelier afirma que se uma mudança de condição é aplicada a um sistema em equilíbrio, o sistema irá se deslocar em uma direção que alivie a mudança.
Exemplos Práticos de Reações de Dupla Troca: Exemplo De Reação Quimica De Dupla Troca
As reações de dupla troca, também conhecidas como reações de metátese, são um tipo comum de reação química que envolve a troca de íons entre dois reagentes. Essas reações são amplamente observadas em diversos contextos, desde a química inorgânica até a química orgânica, e desempenham um papel crucial em diversos processos químicos e biológicos.
Para entender melhor a aplicação prática dessas reações, vamos analisar alguns exemplos concretos.
Reações de Precipitação
Uma das aplicações mais comuns das reações de dupla troca é a formação de precipitados. Um precipitado é um sólido insolúvel que se forma quando duas soluções iônicas são misturadas. A formação do precipitado é geralmente impulsionada pela baixa solubilidade do produto formado.
| Reagentes | Produtos | Condições | Observações |
|---|---|---|---|
| Solução aquosa de cloreto de bário (BaCl2) + Solução aquosa de sulfato de sódio (Na2SO4) | Sulfato de bário (BaSO4) (precipitado branco) + Cloreto de sódio (NaCl) (em solução) | Temperatura ambiente | O sulfato de bário é um composto insolúvel em água, formando um precipitado branco. |
| Solução aquosa de nitrato de prata (AgNO3) + Solução aquosa de cloreto de sódio (NaCl) | Cloreto de prata (AgCl) (precipitado branco) + Nitrato de sódio (NaNO3) (em solução) | Temperatura ambiente | O cloreto de prata é um composto insolúvel em água, formando um precipitado branco. |
Reações de Neutralização
As reações de neutralização são um tipo específico de reação de dupla troca que ocorre entre um ácido e uma base. Essas reações resultam na formação de sal e água. A reação de neutralização é amplamente utilizada para ajustar o pH de soluções e na produção de sais.
| Reagentes | Produtos | Condições | Observações |
|---|---|---|---|
| Ácido clorídrico (HCl) + Hidróxido de sódio (NaOH) | Cloreto de sódio (NaCl) + Água (H2O) | Temperatura ambiente | A reação é exotérmica, liberando calor. |
| Ácido sulfúrico (H2SO4) + Hidróxido de potássio (KOH) | Sulfato de potássio (K2SO4) + Água (H2O) | Temperatura ambiente | A reação é exotérmica, liberando calor. |
Reações de Formação de Gás
Em algumas reações de dupla troca, um dos produtos formados é um gás. A liberação do gás geralmente ocorre devido à sua baixa solubilidade em água ou à instabilidade do composto gasoso em solução aquosa.
| Reagentes | Produtos | Condições | Observações |
|---|---|---|---|
| Carbonato de cálcio (CaCO3) + Ácido clorídrico (HCl) | Cloreto de cálcio (CaCl2) + Dióxido de carbono (CO2) (gás) + Água (H2O) | Temperatura ambiente | O dióxido de carbono é um gás incolor e inodoro, liberado na forma de bolhas. |
| Sulfureto de ferro (FeS) + Ácido clorídrico (HCl) | Cloreto de ferro (FeCl2) + Sulfeto de hidrogênio (H2S) (gás) | Temperatura ambiente | O sulfeto de hidrogênio é um gás tóxico e com odor de ovo podre. |
Reações de Dupla Troca em Química Orgânica
Reações de dupla troca, também conhecidas como reações de metátese, são reações químicas que envolvem a troca de átomos ou grupos de átomos entre dois reagentes. Em química orgânica, essas reações são frequentemente usadas para formar novas ligações carbono-carbono e criar moléculas complexas.
Reações de Dupla Troca em Química Orgânica
As reações de dupla troca em química orgânica são frequentemente usadas para sintetizar novos compostos orgânicos, especialmente na formação de novas ligações carbono-carbono. Essas reações geralmente envolvem a troca de grupos funcionais entre dois reagentes.
Um exemplo clássico é a reação de Wittig, onde um íon ilido reage com um aldeído ou cetona para formar um alceno.
Outro exemplo é a reação de Diels-Alder, onde um dieno cíclico reage com um dienófilo para formar um novo cicloalcano.
Mecanismo das Reações de Dupla Troca em Química Orgânica
O mecanismo das reações de dupla troca em química orgânica varia de acordo com os reagentes e as condições de reação. No entanto, geralmente envolve a formação de um intermediário instável, como um íon carbônio ou um radical livre, que é então atacado por outro reagente.
Por exemplo, na reação de Wittig, o íon ilido reage com o aldeído ou cetona para formar um intermediário instável chamado betaína. A betaína então se decompõe para formar o alceno e um óxido de fósforo.
Produtos Formados nas Reações de Dupla Troca em Química Orgânica
Os produtos formados nas reações de dupla troca em química orgânica dependem dos reagentes e das condições de reação. No entanto, geralmente envolvem a formação de novas ligações carbono-carbono, novas ligações carbono-heteroátomo ou a troca de grupos funcionais.
Por exemplo, a reação de Wittig produz um alceno, a reação de Diels-Alder produz um cicloalcano, e a reação de Grignard produz um álcool.
Comparação das Reações de Dupla Troca em Química Orgânica e Inorgânica
As reações de dupla troca em química orgânica e inorgânica compartilham algumas semelhanças, como a troca de átomos ou grupos de átomos entre dois reagentes. No entanto, existem algumas diferenças importantes:
- As reações de dupla troca em química orgânica geralmente envolvem a formação de novas ligações carbono-carbono, enquanto as reações de dupla troca em química inorgânica geralmente envolvem a formação de novas ligações iônicas.
- As reações de dupla troca em química orgânica são frequentemente usadas para sintetizar novos compostos orgânicos, enquanto as reações de dupla troca em química inorgânica são frequentemente usadas para preparar sais.
- As reações de dupla troca em química orgânica são geralmente mais complexas do que as reações de dupla troca em química inorgânica, pois envolvem a formação de intermediários instáveis.
As reações de dupla troca, como vimos, desempenham um papel crucial em diversos campos da química e da ciência em geral. Compreender os princípios básicos dessas reações é fundamental para desenvolver novas tecnologias, solucionar problemas ambientais e avançar em áreas como a medicina e a agricultura.
Através do estudo aprofundado dos mecanismos, tipos e aplicações das reações de dupla troca, podemos desvendar os mistérios da química e contribuir para a construção de um futuro mais sustentável e próspero.

