De Exemplos De Cada Um Desses Processos Evaporacao Ebulicao Ecalefacao, este artigo mergulha no fascinante mundo das mudanças de estado físico da matéria, explorando os processos de evaporação, ebulição e calefação. Através de exemplos do dia a dia e discussões aprofundadas, desvendaremos os mecanismos por trás dessas transformações, revelando suas aplicações práticas em diversas áreas.
Compreender como a matéria muda de estado é fundamental para diversas áreas do conhecimento, desde a química e a física até a engenharia e a culinária. A evaporação, por exemplo, é essencial para o ciclo da água, enquanto a ebulição é crucial para o cozimento de alimentos e a produção de vapor.
Já a calefação, um processo menos conhecido, desempenha um papel importante em situações de alta temperatura, como em usinas de energia e soldagem.
Mudanças de Estado Físico da Matéria: Evaporação, Ebulição e Calefação: De Exemplos De Cada Um Desses Processos Evaporacao Ebulicao Ecalefacao
A matéria existe em diferentes estados físicos: sólido, líquido e gasoso. A mudança de um estado para outro é chamada de mudança de estado físico, e é um processo físico que envolve a absorção ou liberação de energia. Essas mudanças ocorrem quando a energia cinética das moléculas é alterada, o que afeta a força das interações intermoleculares.
Existem três processos principais de mudança de estado físico: evaporação, ebulição e calefação. Cada processo envolve a transformação de um líquido em gás, mas cada um possui suas características únicas e ocorre sob condições específicas.
Evaporação
A evaporação é um processo gradual de mudança de estado físico em que um líquido se transforma em gás à temperatura ambiente. Ocorre na superfície do líquido, onde as moléculas com maior energia cinética escapam para a fase gasosa.
Para que a evaporação ocorra, algumas condições são necessárias, como:
- Temperatura:Quanto maior a temperatura, maior a energia cinética das moléculas, aumentando a taxa de evaporação.
- Superfície de contato:Uma superfície maior permite que mais moléculas escapem para a fase gasosa, acelerando a evaporação.
- Umidade relativa:Uma baixa umidade relativa facilita a evaporação, pois há menos vapor de água no ar para impedir a evaporação.
- Vento:O vento remove o vapor de água do ar acima do líquido, reduzindo a pressão parcial do vapor e acelerando a evaporação.
A evaporação é um processo comum que acontece no dia a dia. Por exemplo:
| Nome do exemplo | Tipo de líquido | Condições de evaporação | Observações |
|---|---|---|---|
| Roupa secando no varal | Água | Temperatura ambiente, vento, baixa umidade | A evaporação da água da roupa faz com que ela seque. |
| Umidade evaporando do chão após a chuva | Água | Temperatura ambiente, sol, vento | A evaporação da água do chão faz com que ele seque. |
| Café esfriando em uma xícara | Café | Temperatura ambiente, superfície de contato | A evaporação do café faz com que ele esfrie. |
| Suor evaporando da pele | Suor | Temperatura ambiente, vento | A evaporação do suor ajuda a regular a temperatura corporal. |
Ebulição
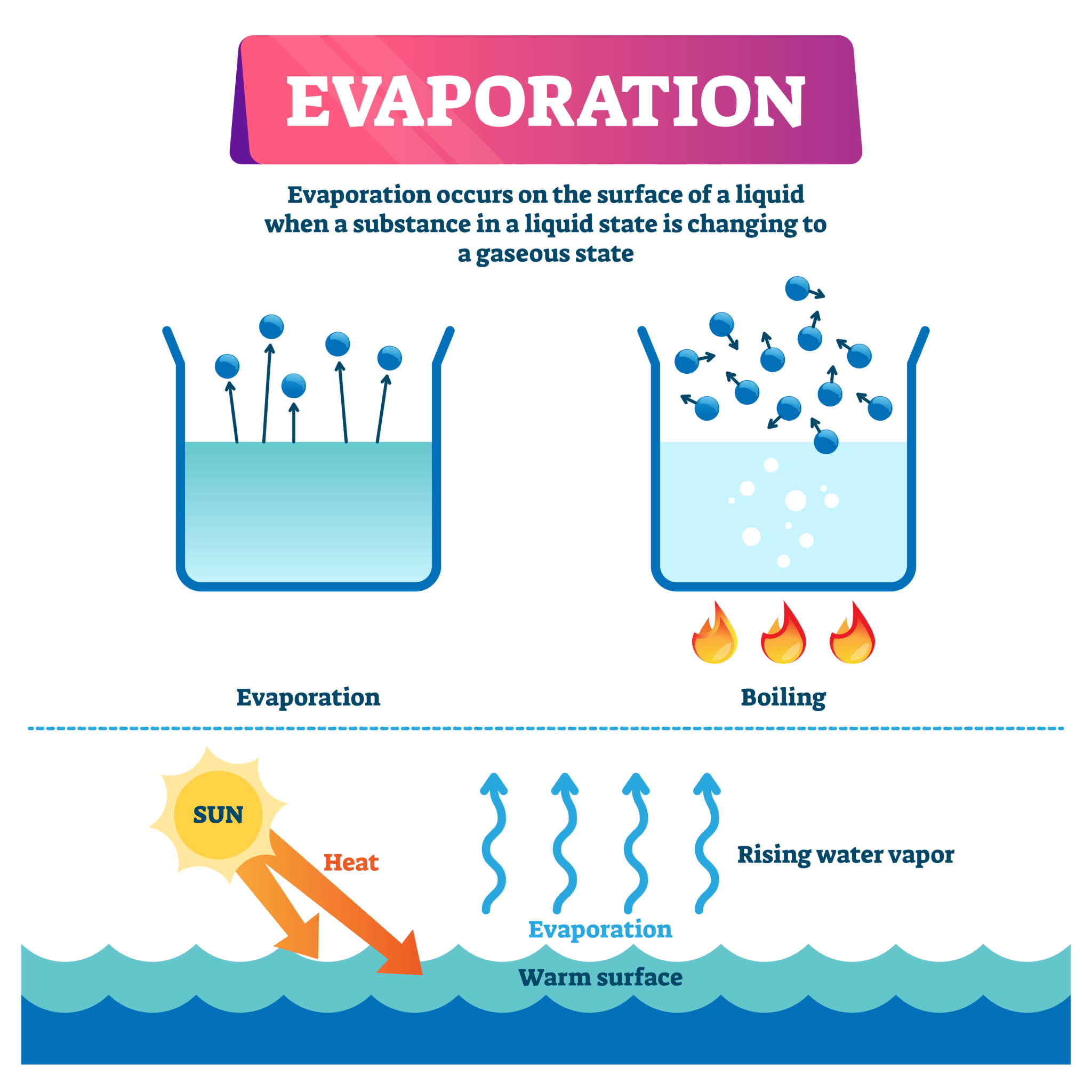
A ebulição é um processo de mudança de estado físico em que um líquido se transforma em gás em todo o seu volume, formando bolhas que sobem à superfície. A ebulição ocorre quando a pressão de vapor do líquido é igual à pressão atmosférica.
A temperatura em que um líquido entra em ebulição é chamada de temperatura de ebulição. A temperatura de ebulição varia com a pressão atmosférica. Quanto maior a pressão atmosférica, maior a temperatura de ebulição. Por exemplo, a água ferve a 100°C ao nível do mar, mas em altitudes mais elevadas, onde a pressão atmosférica é menor, a água ferve a uma temperatura mais baixa.
Diferentes líquidos fervem em temperaturas diferentes. Por exemplo, o éter etílico ferve a 34,6°C, enquanto o mercúrio ferve a 356,7°C. A diferença na temperatura de ebulição é devido às diferentes forças intermoleculares entre as moléculas dos líquidos. Quanto mais fortes as forças intermoleculares, maior a energia necessária para que as moléculas escapem para a fase gasosa, e maior a temperatura de ebulição.
Calefação
A calefação é um processo de mudança de estado físico em que um líquido é aquecido rapidamente a uma temperatura acima de seu ponto de ebulição, sem entrar em ebulição. Isso ocorre porque a transferência de calor é tão rápida que as moléculas do líquido não têm tempo suficiente para formar bolhas de vapor.
Em vez disso, o líquido se transforma diretamente em vapor.
A calefação é um processo que ocorre quando a transferência de calor é rápida o suficiente para evitar a formação de bolhas de vapor. Por exemplo, se você colocar uma gota de água em uma superfície quente, a água pode evaporar instantaneamente sem entrar em ebulição.
A calefação difere da ebulição em alguns aspectos importantes. Na ebulição, o líquido entra em ebulição em todo o seu volume, formando bolhas que sobem à superfície. Na calefação, o líquido se transforma em vapor apenas na superfície em contato com a fonte de calor.
Exemplos de calefação incluem:
- Gotas de água caindo em uma superfície quente, como uma chapa de ferro quente.
- Uma gota de água em contato com um fio quente.
- Um líquido sendo aquecido em um forno de microondas.
Aplicações dos Processos
Os processos de evaporação, ebulição e calefação têm diversas aplicações práticas em diferentes áreas, como indústria, culinária e meio ambiente.

