Apresenta As Principais Características Dos Alcanos E Forneça 2 Exemplos: mergulhe no fascinante mundo dos alcanos, esses compostos orgânicos que formam a base de combustíveis e inúmeros produtos do nosso dia a dia. Vamos desvendar suas estruturas, propriedades e aplicações, explorando desde a simples molécula de metano até os alcanos mais complexos, revelando o papel fundamental que desempenham na química orgânica e na sociedade moderna.
Prepare-se para uma jornada pela química, repleta de detalhes intrigantes e exemplos práticos que irão iluminar a compreensão dessas moléculas essenciais.
Começaremos pela estrutura básica dos alcanos, cadeias de carbono saturadas ligadas apenas por ligações simples, e como essa estrutura influencia suas propriedades físicas e químicas. A nomenclatura, baseada no número de átomos de carbono, será detalhada, seguindo-se uma análise comparativa com outras classes de hidrocarbonetos, como os alcenos e alcinos. Exploraremos a reatividade dos alcanos, focando na combustão – uma reação crucial para a geração de energia – e analisaremos suas propriedades físicas, como ponto de ebulição e solubilidade.
Por fim, apresentaremos exemplos concretos de alcanos e suas aplicações, destacando suas vantagens e desvantagens, além de um aprofundamento no conceito de isomeria.
Introdução aos Alcanos
Os alcanos, também conhecidos como parafinas, são hidrocarbonetos alifáticos saturados, ou seja, compostos orgânicos formados apenas por átomos de carbono e hidrogênio, unidos por ligações simples. Sua estrutura química é baseada em cadeias carbônicas lineares ou ramificadas, sem a presença de ligações duplas ou triplas.
Estrutura Química Básica dos Alcanos
A estrutura básica dos alcanos é uma cadeia de átomos de carbono ligados entre si por ligações simples (ligações sigma), com cada átomo de carbono saturado com átomos de hidrogênio. A fórmula geral dos alcanos é C nH 2n+2, onde ‘n’ representa o número de átomos de carbono na cadeia. Esta fórmula indica que o número de átomos de hidrogênio é sempre o dobro do número de átomos de carbono mais dois.
Nomenclatura dos Alcanos
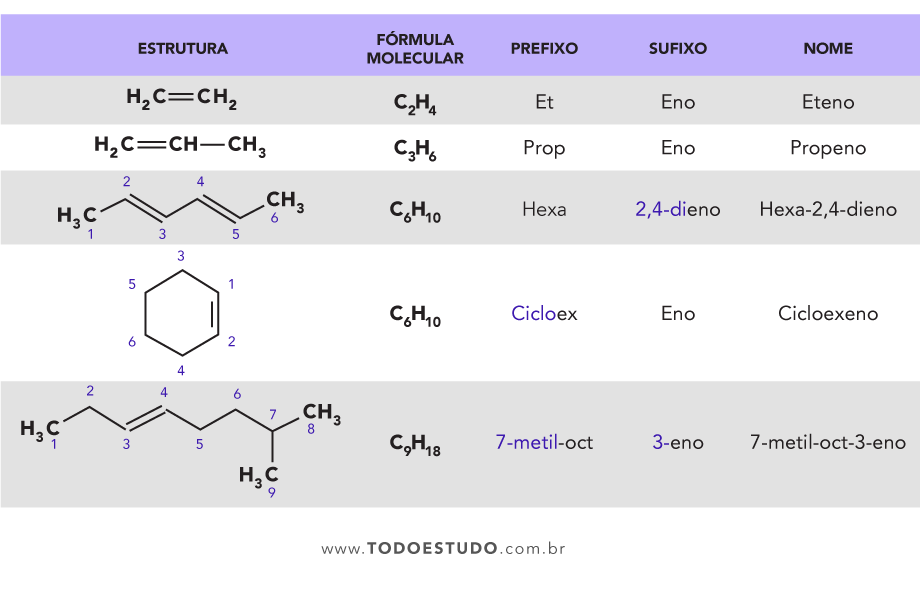
A nomenclatura dos alcanos segue um sistema padrão baseado no número de átomos de carbono na cadeia principal. Os quatro primeiros alcanos são metano (CH 4), etano (C 2H 6), propano (C 3H 8) e butano (C 4H 10). Para alcanos com mais de quatro átomos de carbono, utiliza-se a numeração grega (pentano, hexano, heptano, etc.).
Comparação da Fórmula Geral dos Alcanos com a de Alcenos e Alcinos

Alcanos, alcenos e alcinos são todos hidrocarbonetos, mas diferem na natureza de suas ligações. Alcanos possuem apenas ligações simples (C-C), alcenos possuem pelo menos uma ligação dupla (C=C), e alcinos possuem pelo menos uma ligação tripla (C≡C). Isso resulta em fórmulas gerais diferentes: alcanos (C nH 2n+2), alcenos (C nH 2n) e alcinos (C nH 2n-2).
Propriedades Físicas dos Alcanos
As propriedades físicas dos alcanos são fortemente influenciadas pelo tamanho e pela forma de suas moléculas. O aumento do número de átomos de carbono leva a mudanças significativas em seus pontos de ebulição e fusão, bem como na solubilidade.
Ponto de Ebulição e Ponto de Fusão, Apresenta As Principais Características Dos Alcanos E Forneça 2 Exemplos
Os pontos de ebulição e fusão dos alcanos aumentam com o aumento do tamanho da cadeia carbônica. Isso ocorre devido ao aumento das forças de van der Waals entre as moléculas maiores, requerendo mais energia para superar essas forças e mudar de estado físico. Alcanos de cadeia ramificada possuem pontos de ebulição e fusão menores do que seus isômeros de cadeia linear.
Solubilidade
Os alcanos são essencialmente apolares e, portanto, insolúveis em água (um solvente polar), mas são solúveis em solventes orgânicos apolares, como benzeno e éter.
Tabela de Propriedades Físicas
| Nome do Alcano | Fórmula Molecular | Ponto de Ebulição (°C) | Ponto de Fusão (°C) |
|---|---|---|---|
| Metano | CH4 | -161,5 | -182,5 |
| Etano | C2H6 | -88,5 | -182,8 |
| Propano | C3H8 | -42,1 | -187,7 |
| Butano | C4H10 | -0,5 | -138,4 |
Propriedades Químicas dos Alcanos
Os alcanos são relativamente inertes em condições normais, devido à alta energia de dissociação das ligações C-C e C-H. Sua principal reação é a combustão, uma reação exotérmica com oxigênio.
Reação de Combustão
A combustão completa de um alcano produz dióxido de carbono (CO 2) e água (H 2O), liberando uma grande quantidade de energia. Já a combustão incompleta pode produzir monóxido de carbono (CO) e/ou carbono (C), além de água, liberando menos energia.
Combustão Completa e Incompleta
Combustão Completa do Metano: CH 4 + 2O 2 → CO 2 + 2H 2O
Combustão Incompleta do Etano: 2C 2H 6 + 5O 2 → 4CO + 6H 2O
Comparação da Reatividade com Alcenos e Alcinos
Alcanos são menos reativos do que alcenos e alcinos devido à ausência de ligações duplas ou triplas. As ligações π presentes em alcenos e alcinos são mais reativas que as ligações σ presentes nos alcanos.
Exemplos de Alcanos e suas Aplicações

Diversos alcanos possuem aplicações importantes na indústria e no dia a dia. A seguir, dois exemplos relevantes:
- Metano (CH4): Utilizado como combustível em residências e indústrias, sendo o principal componente do gás natural. Sua alta energia de combustão o torna uma fonte eficiente de energia.
- Vantagens: Abundante, relativamente barato, queima limpa (em combustão completa).
- Desvantagens: Emissão de CO 2 (gás de efeito estufa), riscos de explosão.
- Butano (C4H 10): Utilizado em isqueiros e como propelente em aerossóis. Seu ponto de ebulição relativamente baixo permite sua fácil liquefação em recipientes pressurizados.
- Vantagens: Fácil de armazenar e transportar, alta energia de combustão.
- Desvantagens: Inflamável, pode ser tóxico em altas concentrações.
Isomeria em Alcanos
A partir do butano (C 4H 10), os alcanos podem apresentar isomeria estrutural, ou seja, moléculas com a mesma fórmula molecular, mas diferentes arranjos atômicos. O tipo mais comum é a isomeria de cadeia.
Isômeros de Cadeia
O butano possui dois isômeros: o butano (cadeia linear) e o metilpropano (cadeia ramificada). Embora possuam a mesma fórmula molecular (C 4H 10), suas estruturas são diferentes, resultando em ligeiras diferenças em suas propriedades físicas.
Butano (linear): Representação detalhada: CH 3-CH 2-CH 2-CH 3
Metilpropano (ramificado): Representação detalhada: CH 3-CH(CH 3)-CH 3
Comparação das Propriedades
O butano possui ponto de ebulição ligeiramente mais alto que o metilpropano, devido à maior área de superfície em contato entre as moléculas lineares, levando a forças intermoleculares mais fortes.
Reações de Halogenação dos Alcanos: Apresenta As Principais Características Dos Alcanos E Forneça 2 Exemplos
Alcanos podem sofrer reações de halogenação, onde um ou mais átomos de hidrogênio são substituídos por átomos de halogênio (F, Cl, Br, I). Essa reação ocorre por um mecanismo radicalar.
Mecanismo Radicalar
A halogenação é uma reação de substituição que envolve a formação de radicais livres. Um radical livre é uma espécie química com um elétron desemparelhado, altamente reativa. A iniciação envolve a quebra homolítica de uma molécula de halogênio, formando dois radicais halogênio. A propagação envolve a reação do radical halogênio com o alcano, formando um radical alquila e uma molécula de haleto de hidrogênio.
A terminação envolve a recombinação de dois radicais.
Cloração do Metano
Equação Química Balanceada para a cloração do metano: CH 4 + Cl 2 → CH 3Cl + HCl

